Notion de Mole
Une mole (1 mol) d'une substance chimique contient autant de particules (molécules, atomes, ions, correspondant à la formule chimique) qu'il y a d'atomes dans 12 g de l'isotope 12C, soit 6.022 × 1023 atomes.NA = 6.022 × 1023 (nombre d'AVOGADRO)
La masse d'une mole de substance contenant NA unités formulaires est appelée masse molaire M (g mol-1).
Exemple:


Calculs stoechiométriques
Dans une réaction chimique équilibrée, le bilan de masse de chaque élément doit être satisfait par les coefficients stoechiométriques qui figurent devant les formules moléculaires (loi de la conservation de la masse).![]()

Calculs de résultats à partir de données gravimétriques
Les résultats d'une analyse gravimétrique sont généralement calculés à partir de deux mesures expérimentales: la masse de l'échantillon et la masse d'un produit de composition connue (précipité). Si le produit est l'analyte, on peut exprimer sa concentration en % selon :






Propriétés des précipités et des réactifs précipitants
Un agent de précipitation idéal est: ⇒ spécifique (réagit avec un seul analyte) Exemple: diméthylglyoxime avec Ni2+ Ou tout au moins: ⇒ sélectif (réagit avec un nombre limité d’espèces) Exemple: AgNO3 pour Cl-, Br-, I-, et SCN Un bon agent doit réagir avec l’analyte pour donner un produit:- très peu soluble
- facilement filtrable et lavable de tout contaminant
- stable, en particulier inerte vis-à-vis des constituants de l’atmosphère
- composé pur, de composition constante et connue, à la suite du séchage ou de la calcination
Taille particulaire et filtrabilité des précipités
Les Précipités sont : − particules les plus grandes possible, − faciles à filtrer, − faciles à laver La taille des précipités est influencée par: solubilité, température, conc. réactants, vitesse de mélange des réactants Simplification des effets: La taille dépend d'une seule propriété du système appelée sursaturation relative.
Q: concentration du soluté à tout instant S: conc. du soluté à l’équilibre (solubilité)

![]()
- température élevée → S augmente
- solutions diluées → Q diminue
- adjonction lente de l'agent de précipitation et bonne agitation
- contrôle du pH (si S dépend du pH; exemple: CaC2O4)
Les précipités colloïdaux



Particule colloïdale de chlorure d’argent (chargée positivement) en suspension dans une solution de nitrate d’argent.
- première couche d’absorption: principalement constituée du cation Ag+ (solide) couche du contre ion
- deuxième couche est principalement constitué de NO3- (solution).
Chauffage et Agitation
diminue le nombre de particules adsorbées, diminue l’épaisseur de la double-couche, apporte l’énergie cinétique nécessaire au franchissement de la barrière constituée par les doublescouches.Addition d’un électrolyte
diminution de l’épaisseur de la double-couche, les particules peuvent s’approcher et s’agglomérer.Peptisation d’un colloïde
C’est le processus par lequel un colloïde coagulé est reconverti en suspension colloïdale. Dilemme: lors du lavage d’un précipité, on utilise de préférence le solvant pur (élimination de l’électrolyte pour éviter les contaminations), mais cela conduit à une peptisation dans le cas des colloïdes (précipités par adjonction d’un électrolyte).Traitement de précipités colloïdaux
On procède à une digestion: le précipité est chauffé pendant 1 heure ou plus dans la solution où la précipitation est lente → précipité plus dense et plus facilement filtrable.Les précipités cristallins
Contrôle de la taille: − augmenter S (température, pH) − diminuer Q (solution diluée, ajout lent de l'agent de précipitation, agitation). − digestion: - augmente la pureté et la filtrabilité - recristallisationLa coprécipitation
La coprécipitation est un procédé par lequel des composés normalement solubles sont extraits de la solution par précipitation. La contamination du précipité par une seconde substance dont le produit de solubilité a été dépassé, ne constitue pas en tant que tel la coprécipitation.Types
4 TYPES de COPRECIPITATION: ⇒ ADSORPTION A LA SURFACE. ⇒ FORMATION DE CRISTAUX MIXTES. ⇒ OCCLUSION (poche de solution formée lors d’une croissance cristalline rapide). ⇒ CAPTAGE MECANIQUE (solution trappée entre plusieurs cristaux adjacents).La précipitation homogène
La précipitation homogène est une technique où le réactif précipitant est généré dans la solution par le truchement d'une réaction chimique lente (minimise la sursaturation).
Le séchage et la calcination des précipités
Après filtration et lavage, le précipité est séché à poids constant. Le séchage évapore le solvant et toutes autres substances volatiles incluses dans le précipité.
La calcination est utilisée pour décomposer le solide, et former un composé pur, de composition connue.
Les courbes thermogravimétriques sont obtenues à l'aide de thermobalances (appareil qui enregistre automatiquement, en continu, la masse d'une substance durant l'augmentation de T à vitesse constante).
évapore le solvant et toutes autres substances volatiles incluses dans le précipité.
La calcination est utilisée pour décomposer le solide, et former un composé pur, de composition connue.
Les courbes thermogravimétriques sont obtenues à l'aide de thermobalances (appareil qui enregistre automatiquement, en continu, la masse d'une substance durant l'augmentation de T à vitesse constante).
Avantages et désavantages de méthodes gravimétriques
⇒ Le temps requis pour une analyse gravimétrique est assez long (valable pour des analyses isolées). ⇒ Pas besoin de calibrage ou de standardisation. ⇒ Méthodes sensibles et précises (limitations uniquement dues aux pertes dues à la solubilité, erreurs de coprécipitation, pertes mécaniques). ⇒ Rarement spécifiques, mais sélectives. ⇒ Equipements simples, relativement peu coûteux, fiables.Application des méthodes gravimétriques
Des méthodes ont été principalement développées pour précipiter des anions et cations inorganiques, mais aussi pour H2O, CO2, SO2, I2.Quelques réactifs précipitants inorganiques

*Les caractères gras indiquent que l'analyse gravimétrique est la méthode préférée pour doser l'élément ou l'ion. La forme pesée est indiquée entre parenthèses. ** Un diésis indique que la méthode gravimétrique est rarement utilisée. La méthode gravimétrique la plus fiable est soulignée.
Quelques réactifs précipitants réducteurs
L’analyte est réduit sous sa forme élémentaire pour pesée.
Quelques réactifs précipitants organiques

Méthodes gravimétriques pour les groupements fonctionnels organiques

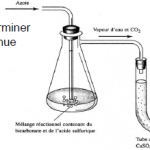
Méthodes de volatilisation
Détermination par exemple de la quantité de CO2, H2O.Types de balances analytiques
Macro balance
- charge maximale de 160 à 200 g
- précision de ± 0.1 mg
Semi-microanalytique
- charge maximale de 10 à 30 g
- précision de ± 0.01 mg
Microanalytique
- charge maximale de 1 à 3 g
- précision de ± 0.001 mg
EVOLUTION DES BALANCES ANALYTIQUES


Macro balance analytique mécanique à 1 plateau

Principe de la balance électrique

Principe de la balance électrique
- Le plateau repose sur un cylindre métallique creux, entouré d'un solénoïde et qui coulisse autour du pôle intérieur d'un aimant permanent cylindrique,
- le courant électrique dans le solénoïde crée un champ magnétique qui soutient par lévitation le cylindre, donc le plateau,
- le plateau est maintenu à niveau par le courant dans le solénoïde > asservissement,
- le courant est proportionnel à la masse,
- elle requiert un étalonnage avec des masses connues,
- elle est plus précise que la balance mécanique.
Last modified: 3 mai, 2015