Les buts de la chimie analytique :
• Séparer • Identifier • Quantifier les constituants d’un échantillon de matière = analytes.
Analyse qualitative
Identification des composants d’un échantillon.Analyse quantitative
Détermination des quantités relatives d'un ou de plusieurs constituants d'un échantillon (analyse qualitative précède l'analyse quantitative).Méthodes de séparation
En général, partie intégrante de l'analyse qualitative et quantitative.Classification des méthodes d’analyse quantitative
Une analyse quantitative nécessite typiquement 2 mesures:- Masse ou volume de l’échantillon
- Une grandeur proportionnelle à la quantité de l’analyte
Les étapes d’une analyse quantitative
Choix de la méthode
− expérience, intuition − exactitude désirée (compromis entre prix/temps et exactitude) − nombre d'échantillon − complexité de l'échantillon − disponibilité d'un laboratoirePrélèvement d’un échantillon représentatif
Exemple : détermination de la teneur en argent de 25 tonnes d'un minerai contenu dans un wagon de chemin de ferPréparation d’un échantillon à l’échelle du laboratoire
− moudre − homogénéiser − éventuellement sécher − préparer plusieurs échantillons représentatifs (~ gramme) pour améliorer l'exactitudeSolubilisation de l’échantillon
− si possible dissolution totaleElimination des interférences
− deux substances peuvent réagir selon la même réaction − possibilité: séparation ou masquage − exemple de masquage : Ca2+ dans l'eau peut être dosé avec EDTA4-; Al3+ réagit aussi mais peut être masqué avec F- qui produit AlF63-Calibrage de la méthode
– nécessaire dans presque tous les cas: CA = cte • X CA = concentration de l'analyte X = grandeur mesurée cte = constante à déterminer − exceptions : gravimétrie, coulométrieCalcul et estimation de l’incertitude
− plusieurs échantillons représentatifs nécessaires − l'évaluation de l'incertitude est nécessaire avant toute interprétation des résultats.Les erreurs dans les analyses chimiques
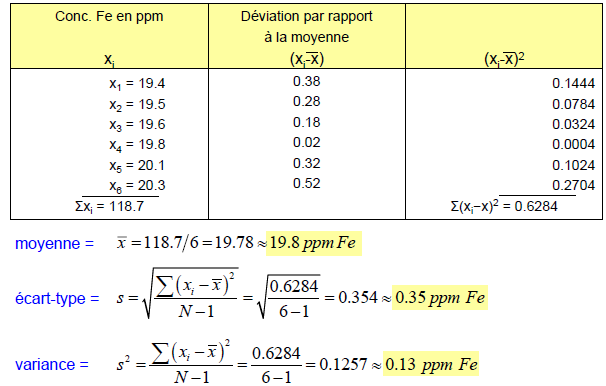
Moyenne arithmétique Pour une série de mesures:
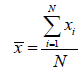
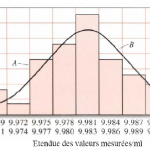
Précision
La précision décrit la reproductibilité (concordance) entre deux ou plusieurs mesures qui ont été réalisées exactement de la même façon. La précision peut s'exprimer de plusieurs façons :
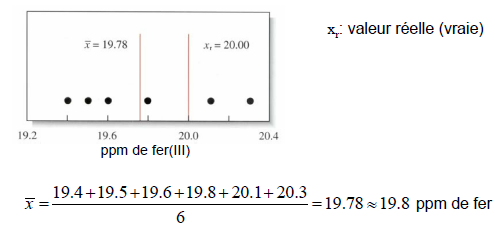
Exactitude (accuracy)
L'exactitude décrit la proximité d'une mesure par rapport à la valeur vraie (ou présumée).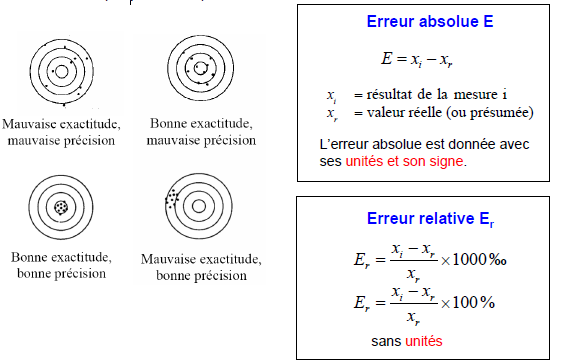
Façons d’exprimer la précision et l’exactitude
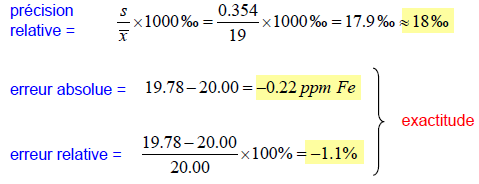
Les types d’erreurs dans les données expérimentales
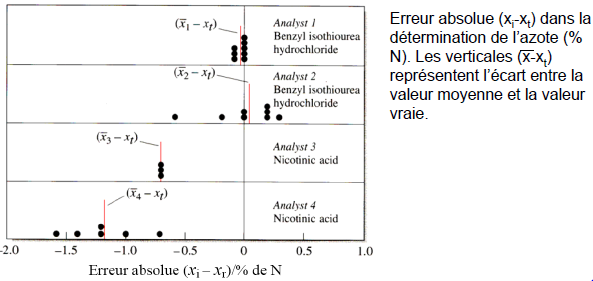
Erreurs aléatoires
− les valeurs sont dispersées de façon plus ou moins symétrique autour de la valeur moyenne (importantes pour les analyste 2 et 4) − cette dispersion est reflétée par la précision − la précision peut être améliorée en augmentant le nombre de mesures.Erreurs systématiques
− ont pour conséquence la différence entre la valeur moyenne et la valeur vraie (importantes pour les analystes 3 et 4 ) − sont reflétées dans l'exactitude.Erreurs grossières
− occasionnelles, souvent très larges (à éliminer lors du calcul d'une moyenne).Les sources d’erreur systématiques
• Erreurs dues aux instruments
− causées par des défauts des instruments de mesure − instabilité des sources de courant, − étalonnage des pipettes, burettes, et ballons jaugés, − utilisation d'instruments en verre à une température trop différente de celle de l'étalonnage, − verrerie sale ou utilisées avec des liquides visqueux. ⇒ on peut remédier à ces erreurs.• Erreurs dues à la méthode
− comportement physique ou chimiques non-idéal: lenteur d'une réaction, réaction incomplète, réactions parasites, − mauvais choix d’un indicateur. ⇒ on peut y remédier par comparaison avec d'autres méthodes.• Erreurs personnelles
− mauvaise estimation de la valeur lue sur une échelle (burette, instrument de mesure, etc.), − mauvaise appréciation d'un changement de couleur lors d'un titrage (daltonisme), − idée préconçue (2ème mesure identique à la 1ère, préférence pour 0 et 5, etc.). ⇒ les appareils à lecture digitale minimisent ce type d'erreur (pas de jugement personnel).L’effet des erreurs systématiques sur les résultats analytiques
• Erreurs constantes
− ces erreurs portent à conséquence lorsque la quantité mesurée est petite. Exemple: 0.50 mg de précipité est perdu par lavage avec 200 ml d’eau lors d’une gravimétrie a) 500 mg précipité e.r. = -(0.50/500)×100% = - 0.1 % b) 50 mg précipitée.r. = -(0.50/50)×100% = - 1.0 %• Erreurs proportionnelles
. Exemple: présence d’un agent contaminant interférant dans le dosage; dosage du Cu2+ en présence de Fe3+: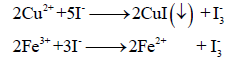
Was this article helpful?
YesNo
Last modified: 2 mai, 2015