Dosage d’un mélange HNO3 + H3PO4
a) Courbe de titrage de HNO3 0.1 M par NaOH 0.1 M

b) Courbe de titrage de H3PO4 0.1 M par NaOH 0.1 M
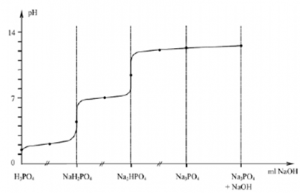 On combine ensuite les 2 courbes de titrages. Des valeurs approximatives de pH sont souvent suffisantes pour le choix de la méthode et des indicateurs (on néglige la dilution) :
On combine ensuite les 2 courbes de titrages. Des valeurs approximatives de pH sont souvent suffisantes pour le choix de la méthode et des indicateurs (on néglige la dilution) :
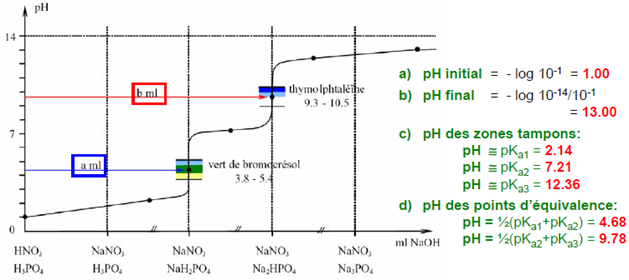 thymolphtaleïne: incolore → bleu
vert de bromocrésol: jaune → bleu
Les deux titrages sont nécessaires.
thymolphtaleïne: incolore → bleu
vert de bromocrésol: jaune → bleu
Les deux titrages sont nécessaires.
Calculs
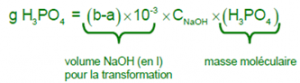 D’autre part, à 1 mole de NaOH correspond 1 mole de HNO3
D’autre part, à 1 mole de NaOH correspond 1 mole de HNO3

Titrage de 20 ml 0.1000 M H3PO4 + 0.1000 M HNO3 avec NaOH 0.1000 M (simulation réelle de la courbe)
 On peut simplifier le titrage en ajoutant du AgNO3 après le virage du vert de bromocrésol et en utilisant le rouge de chlorophénol (jaune−pourpre) comme 2ème indicateur:
On peut simplifier le titrage en ajoutant du AgNO3 après le virage du vert de bromocrésol et en utilisant le rouge de chlorophénol (jaune−pourpre) comme 2ème indicateur:
 Calculs: Considérons la réaction:
Calculs: Considérons la réaction:
 A 1 mole de NaOH correspond 1 mole de HNO3:
A 1 mole de NaOH correspond 1 mole de HNO3:
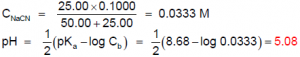
Was this article helpful?
YesNo
Last modified: 28 novembre, 2016


