Titrage par précipitation
Les méthodes titrimétriques utilisant le nitrate d’argent (AgNO3 ) sont généralement appelées « méthodes argentimétriques ». Les méthodes sont basées sur la formation d’un sel d’argent peu soluble (AgCl, AgSCN, etc).
Les dosages les plus importants sont:
a) Titrage de CI – , Br – , I – et SCN – par AgNO 3 avec indication potentiométrique.
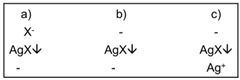
b) Titrage de Cl – selon Mohr: adjonction de K 2 CrO 4 ; au terme du titrage, le précipité de AgCl se colore en brun par précipitation d’un peu de Ag 2 CrO 4 .
c) Titrage de Cl – , Br – , I – ou SCN – selon Fajans: utilisation d’un indicateur d’adsorption.
d) Titrage de CI – selon Vollhard: titrage en retour: détermination de l’excès de AgNO 3 par NH 4 SCN, indication par Fe 3+ ( Fe(SCN) 3 , rouge)
A ces méthodes argentimétriques au sens strict du terme, il y a lieu d’ajouter :
e) Titrage de Ag – par NH 4 SCN (indication par Fe 3+ ) ou par KCl ou KBr (indication potentiométrique).
Sommaire
Courbes de titrage en argentimétrie
Titrage de X – par AgNO 3
La dérivation d’une courbe de titrage argentométrique requiert 3 types de calculs, chacun correspondant à une étape particulière du titrage:
a) Avant P.E.: Calcul de la concentration de l’analyte à partir de sa concentration initiale et des données volumétriques. [Ag + ] est alors obtenue en substituant la concentration de l’analyte dans l’expression du produit de solubilité.
b) Au point d’ équivalence (P.E.): [Ag + ] et [analyte] existent selon les proportions stoechiométriques; [Ag + ] est dérivée du produit de solubilité
c) Après P.E.: La concentration analytique de l’excès de AgNO 3 est calculée. On la considère comme équivalent à sa concentration à l’équilibre.
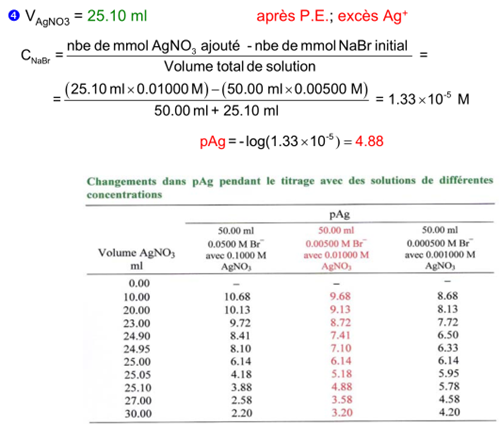
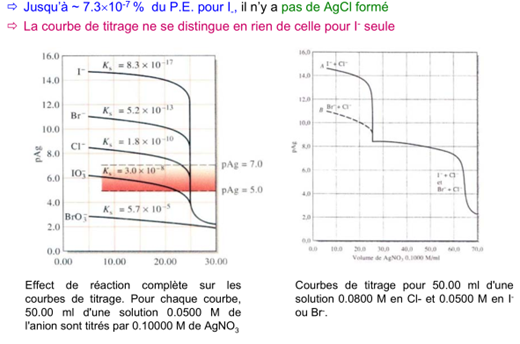
Exemple: Déterminer la courbe de titrage de 50.00 ml d’une solution de NaBr 0.00500 M par AgNO 3 0.01000 M. K s = 5.2 x 10 -13 pour AgBr.
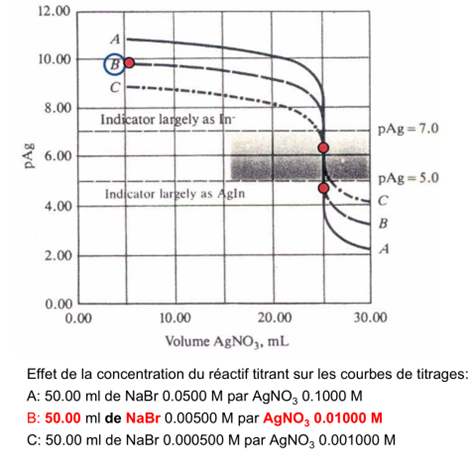
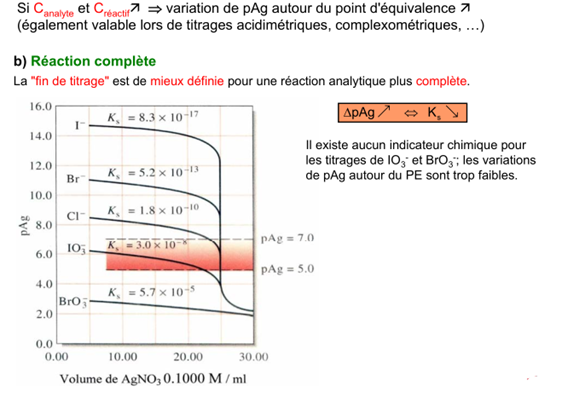
Facteurs influençant l’acuité de la fin du titrage
De manière générale, un point de fin du titrage satisfaisant requiert une variation de 2 unités de la p-fonction (ex. pAg) pour une variation de ± 0.1 ml au point d’équivalence.
Les facteurs influençant l’acuité de la fin du titrage sont les suivants :
a) Concentration du réactif
Courbe A: 50.00 ml de NaCl 0.05500M par AgNO 3 0.1000 M
Courbe B: 50.00 ml de NaCl 0.00500 M par AgNO 3 0.01000 M
Un indicateur pour des pAg compris entre 4 et 6 donne un point de fin de titrage net pour le cas A. Par contre, pour le cas B, le virage commence à 24 ml et se termine à 25 ml, ce qui rend la détection du PE peu précise.
Titrage selon Volhard
a) Titrage direct de Ag +
L’ion de fer(III) sert d’indicateur. La solution vire au rouge dès l’apparition d’un léger excès de SCN – :
Le milieu doit être acide pour éviter la précipitation d’hydroxyde de Fe(III). De plus Fe(OH) 2+ ne forme pas de complexe avec SCN – .
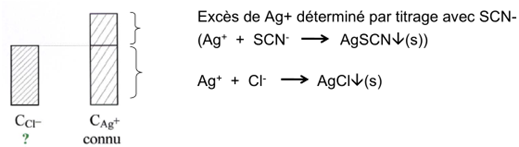
b) Titrage en retour de Cl –
Le Cl – est précipité par un excès de AgNO 3 et cet excès est déterminé par SCN – .
Quand to
ut le Ag + en excès a réagi avec SCN – (le SCN – réagit avec l’indicateur, Fe 3+ , ajouté à la solution) il se forme un complexe de retour rouge.
L’apparition de la couleur indique la « fin de titrage »
⇒ déterminer l’excès de Ag + ⇒ C Ag+ – [Ag + ] excès = [Ag + ] ayant réagi avec Cl –
⇒ on peut déterminer la quantité de Cl – .
Remarques:
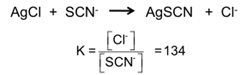
a) K s (AgSCN) = 1.16×10 -12 ⇒ SCN – ne peut pas réagir avec Fe 3+ tant qu’il a y a Ag+ présent en solution, mais on peut avoir formation locale momentanée de [FeSCN)] 2+ pendant le titrage.
b) K s (AgCl) = 1.56×10 -10 > K s (AgSCN) = 1.16×10 -12
⇒ possibilité d’une réaction parasite lorsque tout l’Ag + est précipité
La « fin de titrage » n’est pas nette.
Remède: – Chauffer le précipité avant le titrage en retour ⇒ favorise l’agglomération en gros cristaux, ou – Filtrer AgCl et titrer l’excès de Ag + dans le filtrat, ou – Ajouter quelques ml de nitrobenzène (cancérigène et désuet) ⇒ entoure AgCl et protège de l’attaque de SCN –
c) Les titrages de I – et Br – sont effectués sans isoler le sel d’argent formé, car ces sels sont moins solubles que AgSCN.
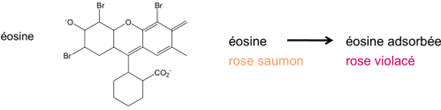
Titrage selon Fajans
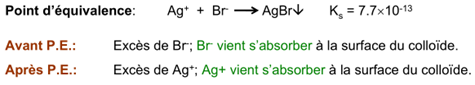
Cette méthode utilise un indicateur d’adsorption. Il s’agit d’un titrage direct.
Le changement brusque de charge négative, puis positive à la surface des colloïdes, apparaît au P.E.
Les amas d’ions chargés se repoussent et ne peuvent pas coaguler, ce qui explique l’opacité de la solution au début du titrage.
Les indicateurs d’adsorption sont généralement des chromophores anioniques, qui sont attirés par les particules de précipité chargées positivement, produits immédiatement après le P.E
Titrage selon Mohr
Dans le titrage selon Mohr, Cl – ou Br – est tiré avec Ag+ en présence de CrO 4 2- .
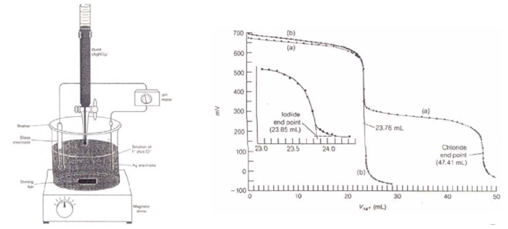
Titrage potentiométrique
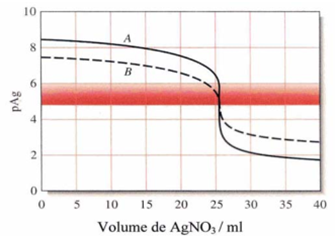
Courbe de titrage de mélanges
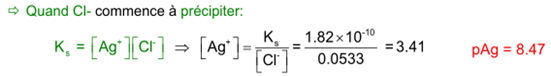
Considérons le titrage de 50.00 ml d’une solution contenant 0.0500 M en I – et 0.0800 M en Cl, par une solution de AgNO 3 0.1000 M.
Au début du titrage, seul AgI précipite.
Quelle est la quantité de I – précipité avant la formation d’AgCl?
Dès l’apparition de AgCl, les expressions des deux K s s’appliquent simultanément.
A partir de ce moment, la diminution du pAg s’interrompt brusquement et sa valeur peu être déterminée à partir du K s (AgCl) et [Cl– ].
Méthodes Argentimétriques de précipitation




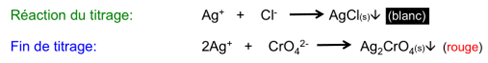
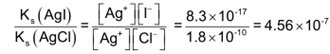


Comments
So empty here ... leave a comment!