Biotransformation des toxiques
La biotransformation est le processus par lequel une molécule mère subit une transformation catalysée par des enzymes spécifiques en métabolites ultérieurement convertis en dérivés conjugués. Les métabolites et les dérivés conjugués sont plus hydrosolubles plus polaires et donc plus facilement éliminables par le rein, et ne subissent pas de réabsorption tubulaire.
But. Détoxication en atténuant la toxicité du toxique ou bioactivation en transformant ce dernier en métabolite plus toxique.
Sommaire
Article complet (PDF) : Biotransformation des toxiques
Mécanismes
Les réactions de la phase I
Oxydation
Ce processus s’effectue par un système monooxygénase dépendant du CYP450, majoritairement localisé dans les microsomes hépatiques. Il y a consommation du NADPH (nicotinamide phosphate réduit) et de l’oxygène moléculaire.
Le CYP450 est une hémoprotéine majoritairement localisée dans les microsomes hépatiques et la face externe de la membrane du réticulum endoplasmique RE. Elle est composée d’un groupement prosthétique appelé l’hème qui est une protoporphyrine IX + FeIII, et une apoprotéine de 45-55 kda qui permet sa classification. Elle absorbe à 450 nm en spectrophotométrie.
Deux éléments sont indispensables pour le fonctionnement du CYP450 : NADPH, et la CYP450 réductase.
Mécanisme d’action
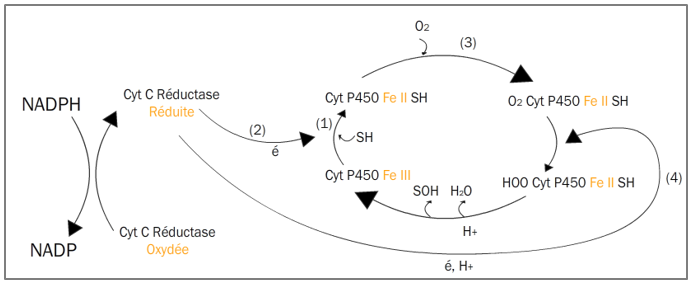
- Liaison Fe3+ (CYP450) et substrat.
- Réduction du Fe3+ en Fe2+ et Formation d’un complexe CYP450 ferreux – substrat.
- Fixation de l’oxygène moléculaire et production du complexe oxyferricytochrome.
- Oxydation du complexe CYP450 ferreux – substrat (Fe2+ à Fe3+) et réduction de l’O2 en O2–.
- Réduction de O2– en O22-.
- Formation de substrat hydroxylé, une molécule d’eau à partir du complexe : Substrat-CYP450 (Fe2+) – OOH. Puis régénération du CYP450 (Fe3+).
Réduction de l’O2 par le CYP450
Dans certains cas, l’auto-oxydation du complexe O2-CYP450 (Fe II) libère l’anion superoxyde ȱ2 (barbituriques). L’anion superoxyde se dismute par la réaction de dismutation en peroxyde d’hydrogène H2O2 et en dioxygène selon la réaction suivante :
2 O2– + 2 H2O → H2O2 + O2 + 2 HO–
En présence de certains métaux de transition, l’anion superoxyde peut réagir aussi avec le peroxyde d’hydrogène H2O2 pour engendrer des radicaux hydroxyles OH° capables d’oxyder certains substrats :
O2°– + H2O2 → OH– + OH° + IO2
IO2 : oxygène singulet (produit par réarrangement des électrons).
Activité peroxydsique du CYP450
En présence de différents hydroperoxydes (dérivés des acides gras non saturés) le CYP450 peut catalyser l’hydroxylation de différents substrats.
Monooxygénase dépendant de la flavine adénine dinucléotide FAD
Ce système enzymatique microsomique peut catalyser l’oxydation des divers composés aminés, soufrés, séléniés tels que les pesticides organophosphorés. Deux enzymes clés sont impliquées : la cyclooxygénase (COX) et la peroxydase.
Contrairement au système microoxygénasique dépendant du CYP450, la fixation du substrat s’effectue après réaction avec l’oxygène. C’est un système moins dépendant de la structure du substrat et donc susceptible de catalyser l’oxydation d’une large variété de substrats.
Oxydation par la prostaglandine synthase
La prostaglandine synthase (PS) est une enzyme localisée dans les membranes microsomiques, elle joue un rôle important dans la biotransformation dans les tissus pauvres en microoxygénase dépendant du CYP450, mais riches en prostaglandine synthase.
Réduction
Ce processus se déroule au niveau du Réticulum endoplasmique des cellules hépatiques, les substrats sont les composés aromatiques nitrés et azoïques, ils sont métabolisés en amines. Le processus est catalysé par des enzymes spécifiques : les réductases.
Ce processus n’est pas exclusivement hépatique, mais également intestinal via la flore bactérienne (plus intense). Certains CYP450 peuvent intervenir en tant que réductases.

Hydrolyse
L’hydrolyse est catalysée par deux familles d’enzymes : les estérases et les amidases. Ce processus concerne une large variété de toxiques (esters et amides) possédant des liaisons sensibles à l’hydrolyse.
Les estérases : peuvent être des arylestérase (esters aromatiques) carboxylestérase (esters aliphatiques) cholinestérases (esters dont le résidu est un alcool) acétylestérases (esters dont la moitié acide est l’acide acétique).
Les amidases : l’hydrolyse par les amidases est plus lente que les estérases. Elles manquent de spécificité de substrat.
Remarque : il existe des réactions qui sont catalysées par des enzymes non microsomiales par exemple l’oxydation réversible par l’ADH cytosolique au niveau du foie (inhibée par le pyrazole), la réduction des doubles liaisons disulfures en thiols (sulfoxydes).
Les réactions de la phase II
Les groupements fonctionnels issus des réactions de phase I peuvent être ensuite conjugués. C’est la réaction de la phase II.
Les mécanismes de conjugaison chez l’homme font généralement appel à l’acide glucuronique, au glycocolle, au sulfate et à l’acétyle.
Conjugaison avec l’acide glucuronique
Ces réactions sont catalysées par l’UDP-glucuronosyltransférase (UGTs) qui permet le transfert de l’acide glucuronique à partir de l’acide UDP-glucuronique sur le groupe accepteur d’un substrat (aglycone) (acide UDP-glucuronique + aglycone à β glucuronide + UDP). Exemple de substrat : composés stéroïdes et l’UGT2. Généralement, des O-glucoronides à partir des groupements alcools (2-dichloroéthanol), des N-glucuronides à partir des groupements aminés aromatiques (aniline), des S-glucuronides à partir des thiols (thiophénol) sont obtenus.
Sulfoconjugaison

L’exemple de la Figure 8.3 montre le mécanisme de formation d’un sulfoconjugué par le transfert des sulfates activés à partir du PAPS (3’ phospho adénosine -5’- phosphosulfate) formé à partir de l’adénosine triphosphate ATP et des sulfates inorganiques aux molécules conjugables (p-nitrophénol). Ce transfert est catalysé par des sulfotransférases dans la fraction cytosolique soluble des cellules.
Acétylation
C’est le transfert de groupement acétyle à partir du coenzyme AcétylCoA aux molécules conjugables. Ce transfert est catalysé par des acétyltransférases (cytosol), exemple : l’acétylation des hydrazines.
Méthylation
C’est le transfert d’un groupement méthyle à partir de la S-adénosylméthionine. Ce transfert est catalysé par les méthyltransférases (cytoplasme). Exemple : la catéchol-O-méthyltransférase COMT et la méthylation des catécholamines.

Conjugaison avec la glycine

La conjugaison de l’acide benzoïque à la glycine est catalysée par la ligase (1e étape), qui active l’acide par le CoA (nécessite l’ATP) et aboutit à la formation d’un dérivé thioester du CoA. Puis la N-acétyltransférase (2e étape) catalyse le transfert du groupement acyle sur le groupement aminé de la glycine.
Conjugaison avec le glutathion

Le tripeptide glutathion constitue plus de 90% de la quantité de thiol non protéinique du foie. Cette réaction est catalysée par une enzyme appelée la glutathion-S-transférase. Elle concerne essentiellement les substances électrophiles (rarement N, O, S), il y a formation d’un X-GSH (X étant le substrat, par exemple : le Paracétamol). Il faut noter qu’il existe des variations au niveau de métabolisme dues à divers facteurs à savoir l’espèce, l’âge, l’état physiopathologique et l’environnement.
L’induction et l’inhibition enzymatiques
L’induction transcriptionnelle se fait par augmentation de la transcription de l’isoforme et augmentation de la synthèse de la protéine. L’induction post-transcriptionnelle quant à elle, se fait par réduction de la dégradation de la protéine, exemple : phénobarbital et le CYP450 2C.
L’inhibition peut être réversible par fixation réversible sur le site actif, dans ce cas ce mécanisme est compétitif et fait intervenir un inhibiteur non métabolique tel que la cimétidine. L’inhibition irréversible se fait par liaison avec le Fe ou le N des noyaux pyroles ou l’apoprotéine, ce qui aboutit à la formation d’un complexe stable (substrat de suicide) d’où l’altération irréversible de l’isoforme, c’est un mécanisme qui fait appel à un inhibiteur métabolisé tel que chloramphénicol et les CYP450 2B 2C.
Conséquences de la biotransformation sur le plan toxicologique
De manière générale, la biotransformation des toxiques à pour conséquences : l’inactivation, c’est-à-dire réduction de la toxicité d’une substance, exemple : cyanures en thiocyanates, ou l’activation c’est-à-dire la toxification d’une substance, exemple : la 2-naphtylamine oxydée en 2-naphtylhydroxylamine cancérigène (responsable du cancer de la vessie).
Bibliographie
- Robert R. Lauwerys; Robert Lauwerys (2007). Toxicologie industrielle et intoxications professionnelles. Elsevier Masson. pp. 32–35. ISBN 978-2-294-01418-5.
- Michael Neal (1 June 2017). Pharmacologie médicale. De Boeck Superieur. pp. 9–11. ISBN 978-2-8073-0611-0.
- Pascal Kintz (1998). Toxicologie et pharmacologie médicolégales. Elsevier Masson. pp. 49. ISBN 978-2-84299-037-4.
